Вода: определение, образование, свойства и применение
Химические названия
Почему же воду назвали водой? Слово «вода» происходит от древнегерманского «мокрый, текучий». В химии могут встречаться разные названия этого соединения. Самые распространенные – гидроксид водорода и окись водорода. Также в химической литературе ее называют:
Образование воды
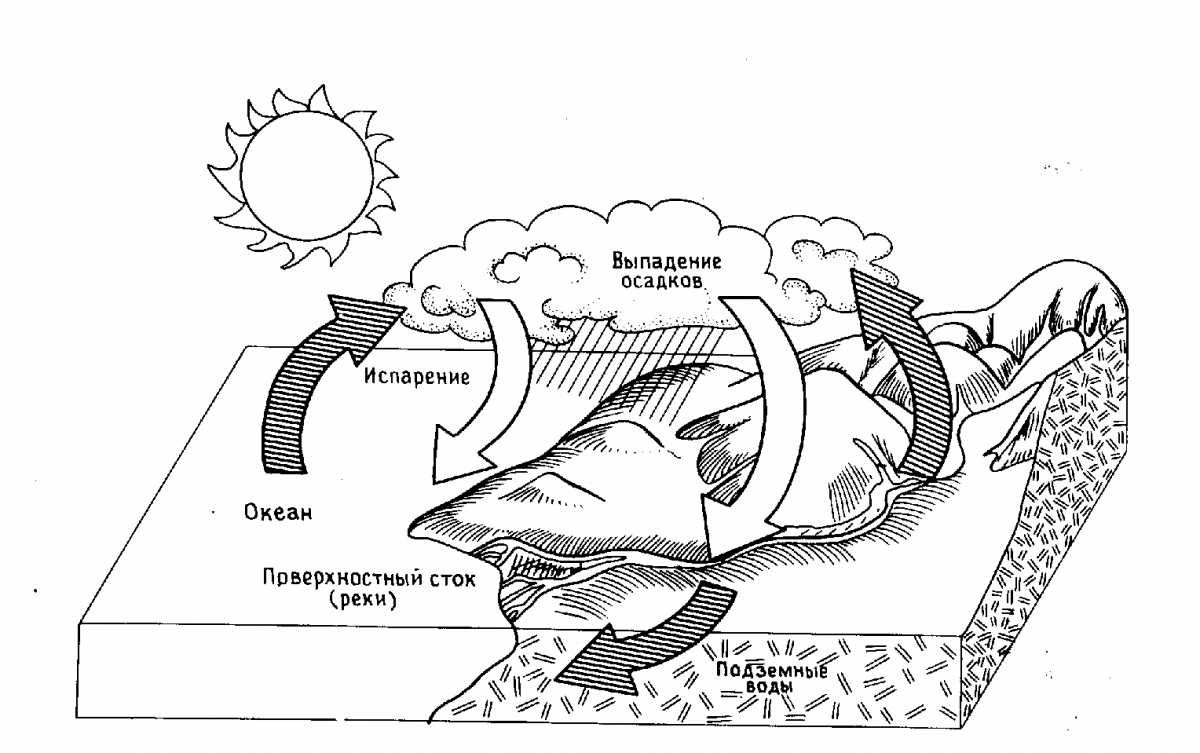
Многих интересует, какая вода находится в реках, морях, под землей. Образовавшаяся миллиарды лет назад вода сконцентрировалась в океанах. Из океанов она испаряется и поднимается, где образуются облака. После долгого путешествия она возвращается на землю в виде осадков. Вода собирается и возвращается через реки обратно в море. Часть просачивается в почву и попадает в грунтовые воды. Там формируются новые источники, которые текут в море.
В более холодном климате вода остается на ледниках, которые очень медленно, стекают к более низким высотам, где и тают. В полярных регионах этот механизм скольжения настолько медленный, что в ледниках можно найти воду, попавшую на поверхность Земли десятки тысяч лет назад. Вот откуда берется в природе вода.
Свойства
Влияние воды на жизнь на земле огромное. Это среда обитания для многих организмов. Она является хорошим растворителем не только для солей, но и для многих других веществ. Например, питательные соли присутствуют в почве в виде ионов, то есть в растворенном виде. Только в таком виде растения могут поглощать их через корни. Поэтому не случайно вода— это источник жизни на земле.
Вода является важным источником химических и биохимических реакций, например, для фотосинтеза. Это заметно, когда растение увядает из-за потери воды, а листья и цветы опадают. Не зря говорят, что вода—это главный источник жизни.
Физические свойства
Что мы все знаем о воде? То, что она состоит из одного атома кислорода и двух атомов водорода, знают все, а вот о том что они притягиваются, друг к другу водородной мостиковой связью знают не все. Эта связь объясняет ее основные свойства.
Агрегатные состояния
В нормальных условиях вода, является жидкостью. Это единственное известное вещество, которое существует в природе во всех трех классических состояниях материи: жидком, твердом, газообразном.
Кстати, термин вода используется для жидкого агрегатного состояния. В твердом, то есть в замороженном состоянии, она называется льдом, в газообразном состоянии— водяным паром или просто паром. Существует порог, где при определенных температурах и равновесного давления три состояния могут сосуществовать одновременно.
Оптические свойства
Когда свет пересекает границу раздела вода-воздух, полное отражение происходит под углом 49 град. Это означает, что световые лучи, попадающие на граничную поверхность, не излучаются из воды, а отражаются.
Преломление света приводит к оптическим иллюзиям. Поэтому под водой объекты видятся не в том месте, где они находятся на самом деле. То же самое происходит если смотреть через воду на воздух. Светопропускная ценность воды обеспечивает присутствие в ней водорослей и растений, которым необходим свет для жизни. Длинноволновый (красный) свет поглощается сильнее, чем коротковолновый (синий) свет.
Изотопные модификации
Молекулы воды состоят из разных изотопов кислорода и водорода, каждый из которых встречается в разных концентрациях. В определенных процессах, таких как образование осадков и фазовые переходы, происходит фракционирование изотопов, то есть Н2О меняет свой изотопный состав. В зависимости от условий окружающей среды и исходного состава это приводит к определенным изотопным сигналам, которые могут выступать в качестве своего рода отпечатка пальца для различных процессов и областей происхождения. Эта методология используется в гидрогеологии и палеоклиматологии.
Химические свойства
Вода амфотерна, в зависимости от окружающей среды, может действовать как кислота и основание. В водных растворах сильные кислоты и сильные основания полностью диссоциируют на ионы H 3 O + и O H. Это называется выравнивающим эффектом воды. Чтобы иметь возможность различать очень сильные кислоты по кислотности, константы равновесия определяют в неводных растворах, и переносят в растворитель воду.
Многих интересует, вода является органическим веществом или неорганическим. С точки зрения химии, она относится к неорганическим веществам. Поскольку, в органики должен присутствовать углерод, а в воде его нет.
Волновая функция основного состояния воды
Под водой скорость звука в 4,4 раза выше, чем у поверхности, и составляет 1483 м /с при температуре 20 С. Поэтому пространственное восприятие звука под водой сильно затруднено, мозг просто не успевает обработать информацию. Важно знать, что звук под водой не только проходит быстрее, но также в большей степени чем в воздухе зависит от частоты. Поэтому глубокие частоты, такие как звуки больших морских двигателей, часто могут быть услышаны драйверами на расстоянии нескольких километров.
В природе
Вода в природе везде. Реки и океаны, облака на небе, к этому добавляются грунтовые воды и те, которые постоянно хранятся в почве и обеспечивает основу для ее плодородия. Вода в природе — это жизнь, без воды все ничто. Она— основа плодородия, без нее не было бы ни растений, ни пищи.
Атмосферные осадки
Вода в природе находится в круговороте. Испаряясь, она поднимается как водяной пар в атмосферу. За тем крошечные капельки собираются и образуют облака. Когда облака попадают в холодный воздух, маленькие капли воды конденсируются и образуют дождь, снег или град.
Вода за пределами земли
Вода за пределами Земли на одних небесных телах находится в твердом состоянии (лед), а на других как водяной пар. В виде льда, она была обнаружена в кометах («грязные снежки»), на Марсе и на некоторых других внешних планетах. Только кольца Сатурна содержат примерно в 20-30 раз больше воды, чем Земля. Доказательства присутствия льда в метеоритных кратерах вблизи полюсов можно найти даже на Меркурии, планете, ближайшей к Солнцу.
Биологическая роль
Вода является источником здоровой жизни и очень важна для организма. Как часть крови, она снабжает нас кислородом и питательными веществами. В то же время токсины транспортируются через кровоток в почки, удаляются из организма. Вода регулирует температуру тела. Если температура воздуха высокая, человек потеет, и тело охлаждается. Однако, если пот не выделяется, то поднимается температура и самочувствие ухудшается.
Многие витамины, молекулы сахара могут использоваться организмом только через воду. Органические вещества расщепляются в воде и транспортируются к нужным органам. Кроме того, она является важным компонентом клеток и тканей. Например, мозг на 90 % состоит из жидкости.
Применение
Вода используется во всех сферах жизни. Люди пьют ее, готовят пищу, поливают растения. На гидроэлектростанциях вода используется, как источник энергии. Она также необходима на фабриках, например, для производства и переработки бумаги. Кстати, для производства одного листа бумаги требуется 10 литров воды! При тушении пожаров без нее не обойтись. Сельское хозяйство было бы невозможно без Н2О.
Многие используют ее в качестве лекарства от разных болезней. Особенно много целебных свойств, приписывают органической воде.
Исследования
Вода существует миллиарды лет, и, казалось бы, что о ней знают все, но она все равно остается тайной. Создаются целые институты, которые пытаются узнать, как сделать аналог воды, откуда она появилась на Земле и в космосе. Они изучают ее влияние на жизнь, ландшафт, природу.
Происхождение воды на планете
Многих интересует, откуда все-таки взялась вода. Она родилась четыре с половиной миллиарда лет назад в глубинах вселенной. Земля, еще не полностью сформированная, состояла в основном из вулканов. Газы, богатые водяным паром, выделялись в атмосферу, там образовывались облака. За тысячелетия земля остыла, и пары, сгущаясь, падали обратно на земную кору в виде дождя. Также формированию этого очень важного источника жизни, способствовали падающие кометы, состоящие в основном изо льда и фрагментов породы. Это явление способствовало образованию рек, озер и океанов, где миллионы лет спустя появились бы первые формы жизни.
Гидрология
Понять, как вода взаимодействует с атмосферой, как влияет на жизнедеятельность, помогает наука гидрология. Она изучает, какая вода находится в водной оболочке Земли. Гидрология помогает понять, как рационально управлять водными объектами. Она составляет прогнозы состояния водных ресурсов, и дает им оценку.
Гидрогеология
Наука, которая изучает подземные воды, гидрогеохимию называется гидрогеология. Гидрогеологи занимаются поиском новых подземных водных источников, изучают, как сделать воду из подземных источников полезной для мелиорации, водоснабжения, природного ландшафта. Данные полученные учеными помогают снизить негативные влияния деятельности людей, на подземные водные источники.
Теперь вы знаете всю правду о воде, и понимаете, насколько важно бережно к ней относится. Ведь если пропадет вода, то не станет и нас.
Рассказ про воду по химии
Вода (химия, 8 класс):
Мы уже много говорили об этом полезном веществе (и вы наверняка о нем уже многое слышали), теперь посмотрим на воду подробнее, с позиции химии.
Формула воды, как вам уже известно, H2O (аш два о)
Около 75% Земли покрыто водой. Примерно такое же количество воды и в человеке.
Даже сухие на вид вещества удерживают в себе много влаги, например, высушенная на воздухе древесина еще содержит 15% воды. Для выпаривания всей воды из древесины требуется еще несколько часов подержать древесину при высокой температуре. И все равно, даже после этого, древесина будет стараться поглотить влагу из воздуха, как и подобные ей гидроскопичные вещества. Также хорошо поглощает из воздуха воду сахар, соль, силикагель (мешочки с шариками в обуви и по совместительству наполнитель для кошачьего туалета) и т.д.
— выше 0 °C и до 100 °C вода жидкая
— при превышении 100 °C кипит
— при 0 °C и ниже превращается в лед. Удивительное качество воды, при замерзании становиться больше (обычно все вещества на холоде уменьшаются), поэтому плотность льда меньше плотности воды и мы ежегодно видим подтверждение этому, ведь лёд не тонет
— при 2500 °C вода разлагается на водород и кислород.
— под действием электрического тока вода также способна к разложению (это реакция электролиза)
— плотность воды 1 г/см 3
— имеет высокую теплоемкость (медленно нагревается, медленно остывает)
— вода без примесей плохо проводит электрический ток и тепло (меньше всего примесей в дождевой воде)
Если в воде растворены минеральные соли из источников, то такая вода называется минеральной.
Вода, которая течет в домах из кранов, предварительно фильтруется, обеззараживается хлором на водоочистительных станциях. Но все равно её качество не всегда удовлетворительное из-за труб и других факторов. Поэтому желательно производить дополнительную обработку воды, пропуская её через собственные фильтры или производя кипячение.
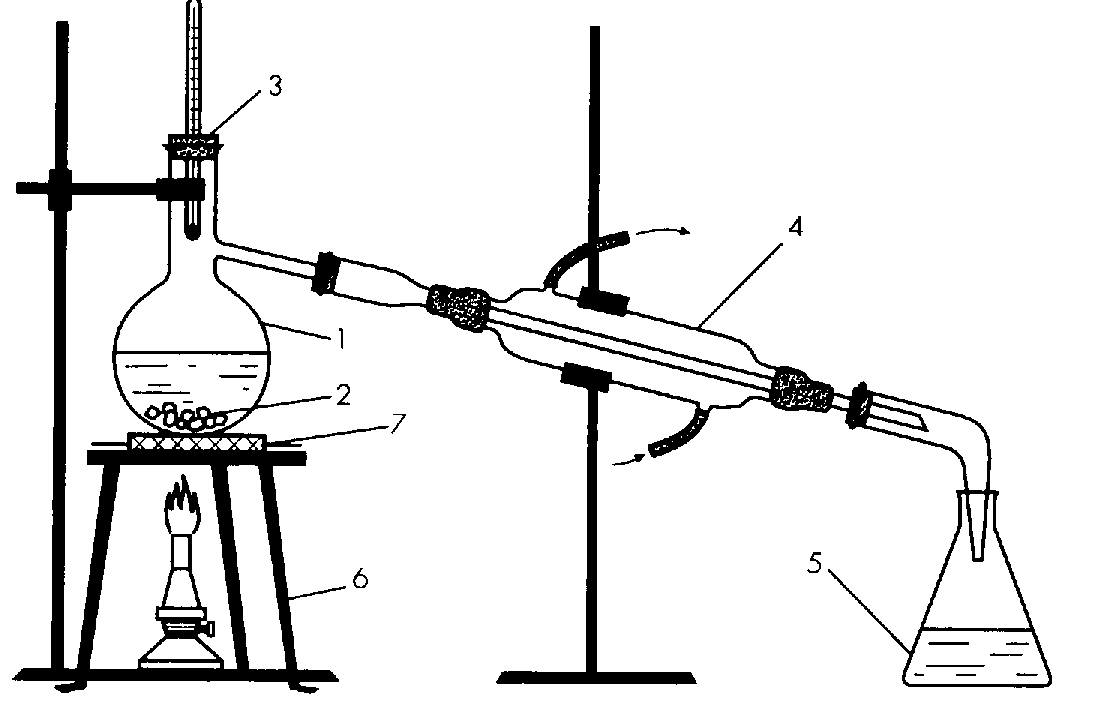
Чистейшую воду для опытов, медицинских и других целей получают дистилляцией (перегонкой). Т.е. нагревают воду, она переходит в пар, пар охлаждается и опять переходит в жидкость. Соли и другие примеси не могут испариться вместе с водой, поэтому такая вода становится практически чистой и называется дистиллированной.
Для питья дистиллированная вода не очень подходит, так как нам необходима вода с солями. При этом количество солей в питьевой воде не должно быть слишком большим. Например, от морской воды быстро становится плохо.
Для нас пригодна речная, ключевая вода, вода из источников, но, к сожалению, постоянные выбросы из канализаций, с заводов, поступление в воды удобрений с полей и другие факторы, портят качество всей воды на планете.
В некоторых регионах мира проблема с водой катастрофическая, например, в большей части Африки, в Китае,…. Китай, в связи с этим, даже начал закупать воду в России из озера Байкал.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или задание
Добавить интересную новость
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
При правильном ответе Вы получите 2 балла
Отметьте верные утверждения о воде
Выберите те ответы, которые считаете верными.
Добавление комментариев доступно только зарегистрированным пользователям
Lorem iorLorem ipsum dolor sit amet, sed do eiusmod tempbore et dolore maLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborgna aliquoLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempbore et dLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborlore m mollit anim id est laborum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Lorem ipsum dolor sit amet, consectetu sed do eiusmod qui officia deserunt mollit anim id est laborum.
Lorem ipsum dolor sit amet, consectetur adipisicing sed do eiusmod tempboLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod temLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborpborrum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Рассказ про воду по химии
ВОДА – оксид водорода H2O.
В течение многих столетий вода считалась простым веществом. Лишь в 1783 французский химик Антуан Лоран Лавуазье (1743–1794) сумел разложить ее. Он показал, что вода состоит из водорода и кислорода, а в 1789 дал первую оценку ее количественного состава: 15% водорода и 85% кислорода. В дальнейшем количественный анализ воды проводили многие ученые. Долгое время образцовыми считались результаты французского химика и физика Жозефа Луи Гей-Люссака (1778–1850), полученные около 1808: 13,27% водорода и 86,73% кислорода. Только в 1821 шведский химик Йенс Якоб Берцелиус (1779–1848) и французский физик и химик Пьер Луи Дюлонг (1785–1838) сделали более правильный анализ воды и нашли, что она содержит 11,1% водорода и 88,9% кислорода, что очень близко к современным значениям (11,19% водорода и 88,81% кислорода).
Изучая объемные отношения реагирующих газов, Гей-Люссак показал, что один объем кислорода и два объема водорода при взаимодействии дают два объема водяного пара (при температуре выше 100° С). На основании этих результатов с учетом закона Авогадро был сделан вывод, что две частицы водяного пара образуются из одной частицы кислорода и двух частиц водорода. Таким образом была выведена формула воды H2O.
На нашей планете вода играет очень важную роль. В природе она совершает непрерывный круговорот. Под влиянием солнечной энергии жидкая вода (главным образом, в теплых морях и океанах) превращается в пар, который поднимается в верхние слои атмосферы. Это происходит благодаря тому, что водяной пар легче воздуха. Так происходит образование облаков, которые ветрами переносятся в другие части планеты, где в виде дождя и других осадков вода попадает на поверхность земли. Здесь она образует ручьи и реки, которые возвращают испаренную воду в океаны (рис. 1).
Чистой воды в природе нет. Даже наиболее чистая дождевая вода при падении через атмосферу растворяет газы и захватывает пыль. При ее испарении всегда остается небольшой остаток – около 0,03 г на литр. На поверхности земли вода дополнительно растворяет многие твердые вещества. Часть ее впитывается в почву. В глубине земли продолжается растворение различных веществ, так что при выходе на поверхность вода иногда образует минеральные источники. Ключевая и колодезная вода от растворенных в ней солей часто бывает жесткой.
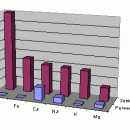
Речная (пресная) вода содержит до 0,5 г растворенных солей в одном литре. В конце концов, все это попадает в море. Таким образом, море, испаряя чистую воду, получает взамен воду с растворенными в ней веществами. Количество солей, поставляемое реками в моря и океаны, огромно. Так, река Дон ежегодно вносит в Азовское море около 16 млн. т солей, Дунай в Черное море – 9 млн. т.
В океанской воде содержится около 35 г солей в литре. Столько же имеется в водах большинства морей. Однако для закрытых морей встречаются отклонения от средней солености, связанные с числом впадающих рек, средней температурой и другими факторами. Балтийское море содержит лишь 3–8 г солей на литр, а Красное – до 45 г. В соленых озерах содержание солей может быть намного больше: в Мертвом море – 228 г в одном литре, в оз. Эльтон – 270 г. В морской воде растворен, в основном, хлорид натрия; кроме того, имеются и другие соли натрия, магния, кальция.
Для научной работы, а также для фармацевтических и других целей, воду перегоняют (рис. 2). Для этого ее превращают в пар, который затем охлаждают, получая чистую дистиллированную воду. Примеси остаются в перегонном сосуде.
Природная вода содержит следы «тяжелой» воды (оксида дейтерия) D2O. Физические свойства H2O и D2O заметно различаются.
| H2O | D2O | |
| t плав.,°С | 0,0 | 3,8 |
| t кип., °С | 100,0 | 101,4 |
Свойства воды служат точкой отсчета для многих физических величин. Так, температуры замерзания и кипения воды лежат в основе шкалы Цельсия. Один литр – это объем 1 кг чистой воды, взвешенной при +4 °С (при этой температуре вода имеет максимальную плотность).
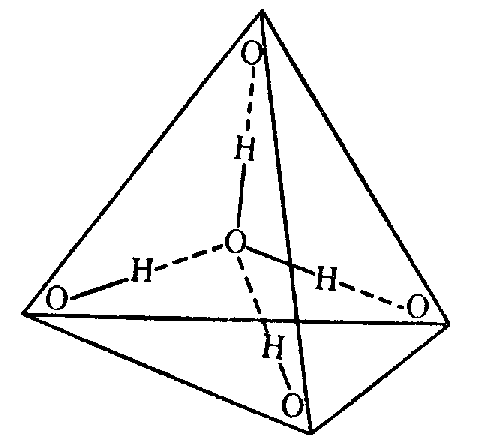
Многие физические свойства воды аномальны по сравнению с другими жидкостями. Одной из причин этого служат малые размеры молекул воды – минимальные среди всех жидких веществ при обычных условиях. Однако наиболее важным свойством воды является ее способность образовывать прочные водородные связи.
В водяном паре при температуре кипения и атмосферном давлении присутствует около 1% димеров, в которых молекулы воды объединены в пары водородными связями. В жидком и твердом состоянии каждая молекула воды образует четыре водородные связи: две как донор протонов и две – как акцептор протонов. Водородные связи молекулы воды направлены приблизительно к вершинам правильного тетраэдра (рис. 3.).
Если бы водородных связей не было, то температуры плавления и кипения воды были бы существенно ниже, как это наблюдается у других водородных соединений неметаллов. Водородные связи являются причиной и другого уникального свойства воды – при плавлении ее плотность возрастает. При 0°С плотность льда (0,9168 г/см 3 ) меньше, чем плотности жидкой воды (0,9998 г/см 3 ), поэтому лед плавает на поверхности воды. Если бы у льда была более высокая плотность, по мере замерзания он опускался бы на дно, что сделало бы жизнь в водоемах зимой невозможной.
Чтобы превратить воду в пар, надо затратить много энергии – около 44 кДж/моль. При обратном переходе пара в жидкую воду выделяется то же количество теплоты.
Вода устойчива при нагревании вплоть до 1000°С. При более высоких температурах она частично разлагается на водород и кислород. Эти же продукты образуются при электролизе воды.
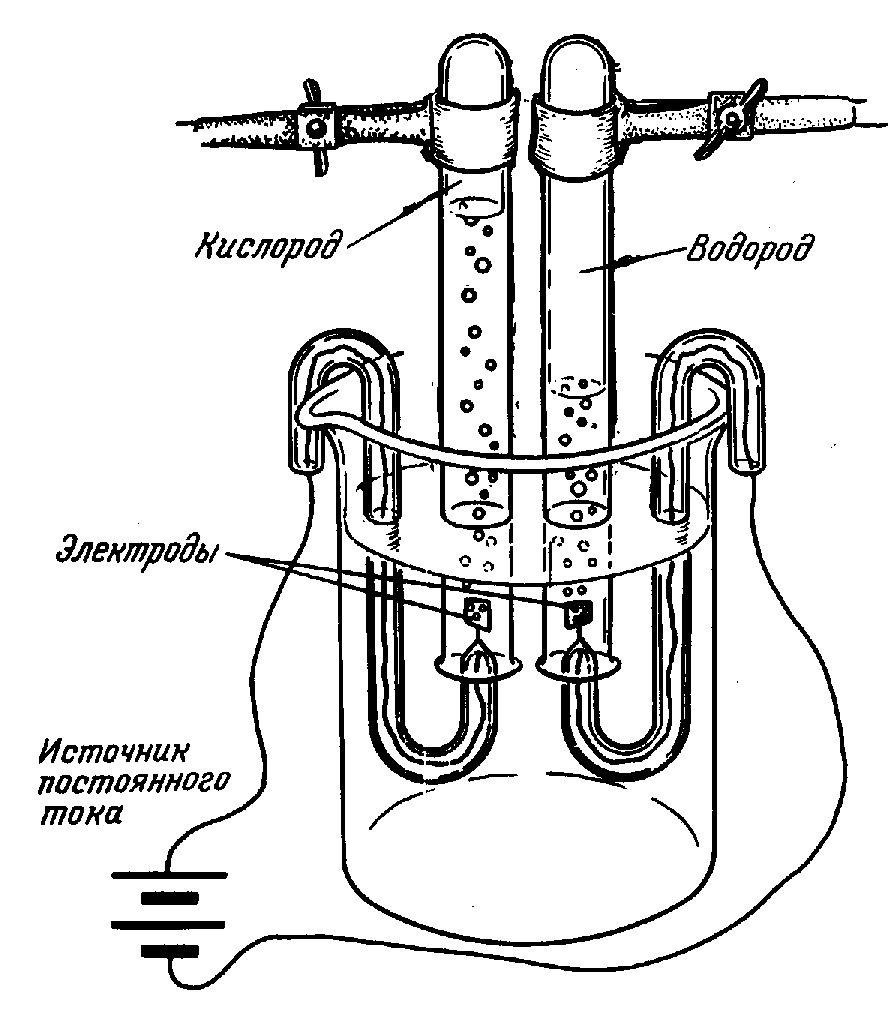
Разложение воды искрами электрической машины заметили еще в 1789, а годом позже воду разложили с помощью гальванического электричества. В России это впервые было сделано профессором С.-Петербургской Медико-Хирургической Академии В.В. Петровым летом 1802 посредством огромной «гальвани-вольтовой батареи», состоявшей из 4200 медных и цинковых кружков. Электролиз чистой воды идет очень медленно. Для более быстрого разложения воды электрическим током в нее добавляют какую-либо кислоту, щелочь или соль. Этот процесс иногда используют для получения чистого водорода и кислорода (рис. 4).
Вода вступает в химическое взаимодействие со многими простыми веществами. Большинство таких реакций протекает при высокой температуре. Только наиболее активные металлы (щелочные и щелочноземельные) и неметаллы (галогены) реагируют с водой при комнатной температуре. Однако при одновременном воздействии воды и окислителей даже при обычной температуре происходит разрушение металлов средней активности (таких как железо) в результате коррозии.
Очень сильными восстановителями вода восстанавливается до водорода, очень сильными окислителями – окисляется до кислорода.
Вода взаимодействует со многими основными оксидами с образованием гидроксидов. В реакциях воды с большинством кислотных оксидов образуются кислоты.
РЕАКЦИИ ВОДЫ
| С простыми веществами: | |
| металлами | неметаллами |
| 2Na + 2H2O = 2NaOH + H2 | Cl2 + H2O⇋ HCl + HClO |
| 2Fe + 3H2O = Fe2O3 + 3H2 (600 °C) | H2O + C ⇋ CO + H2 (800–1000 °C) |
| С оксидами: | |
| основными | кислотными |
| CaO + H2O = Ca(OH)2 | SO3 + H2O = H2SO4 |
| Na2O + H2O = 2NaOH | N2O5 +H2O = 2HNO3 |
| Термическое разложение: 2Н2О⇋ 2Н2 + О2 | |
Некоторые сложные вещества полностью разлагаются водой – подвергаются необратимому гидролизу:
Вода может служить катализатором. Например, щелочные металлы и водород реагируют с хлором только в присутствии следов воды. Иногда вода является каталитическим ядом, например, для железного катализатора при синтезе аммиака.
В результате образования водородных связей твердая вода (лед) имеет рыхлую структуру с обширными замкнутыми полостями двух типов: больших и малых. В этих полостях могут размещаться молекулы других веществ, имеющие соответствующие размеры. Они удерживаются в них ван-дер-ваальсовыми силами. Так образуются газовые гидраты – клатраты, соединения типа «гость-хозяин», в которых «гостями» являются молекулы газов или легкокипящих жидкостей (благородные газы, галогены, углеводороды и др.), а «хозяевами» – молекулы воды, образующие кристаллический каркас. По внешнему виду газовые гидраты напоминают снег или рыхлый лед, но могут существовать только при повышенном давлении и отрицательной (по Цельсию) температуре. Наиболее важным на сегодняшний день газовым гидратом является гидрат природного газа метана, колоссальные скопления которого обнаружены в недрах земли, в особенности на шельфе морей и океанов.
Вода хорошо растворяет многие вещества, имеющие ионное строение (соли, щелочи), а также вещества, молекулы которых полярны. Наличие в жидкой воде ассоциатов (элементов кристаллической структуры) наряду с большим дипольным моментом молекул приводит к высокой диэлектрической проницаемости воды (ε = 78,3 при 25 °С). Это вызывает заметное ослабление кулоновского притяжения в водной среде, а, следовательно, способствует электролитической диссоциации ионных и полярных ковалентных соединений. При этом полярные молекулы воды участвуют в процессе гидратации за счет притяжения соответствующих полюсов полярных молекул воды к образующимся катионам и анионам. В ряде случаев образующиеся связи являются настолько прочными, что можно говорить о возникновении аквакомплексов. Аквакомплексы обнаружены не только в водных растворах, но и во многих кристаллических структурах.
Твердые вещества, как правило, лучше растворяются при нагревании. При этом вещества с очень прочной кристаллической решеткой мало растворимы в воде. К ним относятся хлориды, бромиды и иодиды серебра и свинца, сульфаты щелочноземельных металлов и свинца, большинство гидроксидов, сульфидов, ортофосфатов и карбонатов металлов.
Газы обычно плохо растворяются в воде. Исключение составляют газообразные вещества, взаимодействующие с водой, например аммиак, хлороводород или диоксид серы. Растворимость всех газов возрастает при увеличении давления и, как правило, понижается при нагревании.
В жидкой воде одна из каждых 10 миллионов молекул диссоциирует, образуя ионы: катионы водорода Н + и гидроксид-ионы ОН – :
Н2О ⇋ Н + + ОН –
| Индикатор | Кислотная среда | Нейтральная среда | Щелочная среда |
| Лакмус | Красный | Фиолетовый | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
| Вещества | Сильные | Слабые |
| Основания | NaOH, KOH, Ca(OH)2, Ba(OH)2 | NH3 |
| Кислоты | HCl, HBr, HI, H2SO4, HNO3 | H3PO4, H2CO3, H2S |
Соли при растворении в воде диссоциируют на катионы металла и анионы кислоты. Растворы многих солей имеют кислотную или щелочную среду за счет обратимого гидролиза по катиону или по аниону (см. ГИДРАТАЦИЯ, ГИДРАТЫ, ГИДРОЛИЗ).
| СОЛЬ | ГИДРОЛИЗ | СРЕДА РАСТВОРА | рН | ||||||||||||||||||
| Катион | Анион | ||||||||||||||||||||
| сильного основания | сильной кислоты | — | нейтральная | 7 | |||||||||||||||||
| сильного основания | слабой кислоты | по аниону | щелочная | > 7 | |||||||||||||||||
| слабого или малорастворимого основания | сильной кислоты | По катиону | кислотная | 7 + + HCO3 – HCO3 – + H2O ⇋ H2CO3 + OH – Вода используется во многих технологических процессах главным образом как охлаждающая жидкость, транспортирующая среда для сыпучих материалов (например, золы), важнейший растворитель, реагент. Тяжелую воду применяют в качестве эффективного замедлителя нейтронов. Обычная вода не токсична, однако тяжелая вода опасна для млекопитающих. Вода является жизненно важным веществом. Она является обязательным компонентом всех живых существ. Организм взрослого человека массой 65 кг содержит до 40 кг воды. Вода является растворителем, составной частью клеток, участником биохимических реакций. Она играет важную роль в терморегуляции. У взрослого человека суточная потребность в воде составляет примерно 2,4 кг. Сюда включается вода, поступающая в организм с твердой и жидкой пищей, в виде напитков, а также вода, образующаяся в результате дыхательных процессов (около 300 г). Очень важен минеральный состав питьевой воды. Человек употребляет для питья воду, содержащую от 0,02 до 2 г минеральных веществ на 1 л. Большое значение имеют вещества, находящиеся в малых концентрациях, но играющие важную роль в физиологических процессах организма. Например, длительное употребление питьевой воды, содержащей фтора менее 0,6 мг/л, ведет к кариесу зубов, а потребление воды с концентрацией фтора более 1 мг/л вызывает флюороз. Если в питьевую воду попадают возбудители инфекционных заболеваний, она может явиться фактором их распространения. Многие возбудители кишечных инфекций сохраняют свою жизнеспособность в воде в течение нескольких месяцев. При определении качества питьевой воды немаловажное значение имеют свойства, воспринимаемые органами чувств (органолептические свойства): температура, прозрачность, цвет, запах, вкус, жесткость. Питьевая вода должна быть безопасной в эпидемиологическом отношении, безвредной по химическому составу, благоприятной по органолептическим свойствам. Чтобы использовать для питья природную воду, ее обычно очищают. С этой целью применяют как физические (фильтрование, отстаивание), так и химические (хлорирование, озонирование) методы. В 1 мл питьевой воды должно быть не более 100 микроорганизмов (число бактерий группы кишечных палочек – не более 3). Не менее жесткие ограничения накладываются на содержание химических веществ.
Общая жесткость питьевой воды должна быть не выше 7,0 ммоль/л, а сухой остаток – 1000 мг/л. Значения рН не должны выходить за пределы 6,0–9,0. Ресурсы питьевой воды не безграничны. Проблема обеспечения питьевой водой растущего народонаселения является одной из наиболее острых экологических проблем современности. На возобновляемые водные ресурсы – речной сток воды – оказывает влияние не только растущее загрязнение окружающей среды, но и глобальное потепление климата Земли. Хотя в ряде районов России увеличение количества атмосферных осадков и повышение температуры воздуха в холодное время года благоприятно отражаются на стоке воды рек, на северо-западе и юге нашей страны наметилась тенденция к уменьшению количества ежегодно возобновляющихся водных ресурсов. Для предотвращения водного кризиса, помимо усиления административных мер по охране природных ресурсов, необходимо экологическое образование население. Это должно помочь правильному восприятию взаимосвязей между всеми сферами Земли, включая ее водную оболочку. Кольман Я., Рём К.-Г. Наглядная биохимия (перевод с нем.) – М., Мир, 2000 | |||||||||||||||||